
一、综述摘要
本研究开发了yolk-shell结构的纳米粒子(SiF@MnL/C6-C NPs),该粒子集成了内源性剪切应力触发的接触电致发光与协同摩擦催化和光动力疗法(PDT),用于血栓的诊疗一体化。具体而言,通过在SiF核上依次沉积氟化硅(SiF)层和锰掺杂的镥铝石榴石(MnL)荧光材料层,随后蚀刻SiF中间层,并在表面嫁接二氢卟吩e6(Ce6)和Cys-Arg-Glu-Lys-Ala(CREKA)肽,制备得到SiF@MnL/C6-C NPs。剪切应力激活核与壳之间的持续碰撞,产生摩擦电电荷,进而触发界面电子转移,实现摩擦催化和MnL中的电子跃迁,产生摩擦发光。这种内源性发光激发Ce6,用于现场血栓诊断,同时PDT与摩擦催化协同作用,放大活性氧(ROS)的产生,实现溶栓。碱性蚀刻优化表面粗糙度,显著增强摩擦电势,提升发光强度和ROS生成,实现实时栓塞诊断、有效溶栓和完全血流恢复,同时最小化出血风险和全身毒性。本研究提出了一种简化的诊疗策略,利用内源性剪切应力适应性摩擦发光成像,结合摩擦催化-PDT协同作用,实现靶向溶栓。
二、研究背景
血栓性疾病已成为全球健康威胁,其发病率和死亡率持续上升。血栓形成会部分或完全阻塞血管,是中风、心肌梗死、外周血管疾病、肺栓塞和慢性残疾等多种疾病的关键病理机制。及时清除血栓对于恢复血流和减轻组织损伤至关重要。尽管介入和手术疗法在临床上广泛应用,但它们通常具有侵入性,且受栓塞位置限制,常伴随血栓复发。现有的溶栓药物如抗血小板药、抗凝剂和纤溶药,存在半衰期短、血栓靶向性差及潜在过敏反应等问题。高剂量使用虽可提高疗效,但可能引发致命副作用,如内脏出血、脑水肿和神经毒性。
动态疗法通过激活光敏剂或声敏剂产生反应性自由基,破坏血栓中的纤维蛋白支架,实现有效溶栓和血管再通。然而,外部光和超声波激发在血栓部位的局部应用受到穿透深度有限、能量耗散和定位能力差的挑战。此外,低敏化剂在血栓部位的积累和间歇性刺激也限制了其疗效。因此,开发一种能够精准靶向血栓部位并实现可控激活的诊疗一体化策略具有重要意义。
血栓成像对于及时干预和预防血栓性疾病的致命并发症至关重要。尽管超声、磁共振成像和计算机断层扫描等临床成像技术已广泛应用于血栓成像,但它们存在功能信号弱、空间分辨率低、耗时且需要笨重设备等局限性。光学荧光成像因其高时空分辨率和灵敏度,通过非侵入性辐射,显示出在增加血栓事件诊断准确性和监测溶栓治疗方面的巨大潜力。然而,传统光学成像依赖于外部激发光,其在组织中的穿透深度有限,光衰减显著,且存在背景自发荧光等问题。
三、研究进展
1. Yolk-Shell纳米粒子的设计与合成
本研究设计了yolk-shell结构的SiF@MnL/C6-C NPs,通过顺序沉积和选择性蚀刻策略制备。首先,在SiF核上依次沉积SiF层和MnL层,形成SiF/SiF/MnL结构。随后,在聚乙烯吡咯烷酮(PVP)保护下,选择性蚀刻SiF中间层,形成yolk-shell结构。最后,通过化学嫁接将Ce6和CREKA肽连接到MnL壳上,得到SiF@MnL/C6-C NPs。CREKA肽的引入赋予了NPs对纤维蛋白的高亲和力,实现了血栓部位的特异性积累。
表征分析显示,SiF@MnL/C6-C NPs具有清晰的yolk-shell结构,平均粒径约为376 nm,表面粗糙且多孔,为机械相互作用提供了充足的空间。**X射线衍射(XRD)和X射线光电子能谱(XPS)分析证实了Mn4+和Mg2+的成功掺杂,且未改变SiF的化学性质。紫外-可见(UV-Vis)光谱和傅里叶变换红外光谱(FTIR)**进一步验证了Ce6和CREKA的成功负载。
2. 剪切应力触发的摩擦发光与ROS生成
在动态流动系统中,SiF@MnL/C6-C NPs在剪切应力作用下,SiF核与MnL壳之间的持续碰撞产生摩擦电电荷,触发界面电子转移,实现摩擦催化和MnL中的电子跃迁,产生摩擦发光。这种内源性发光激发Ce6,产生单线态氧(1O2)等ROS,用于血栓成像和PDT。同时,摩擦催化过程中产生的超氧阴离子自由基(·O2−)进一步放大了ROS的生成,增强了溶栓效果。
有限元分析和开尔文探针力显微镜(KPFM)研究揭示了表面粗糙度对摩擦电势的显著影响。Na2CO3蚀刻优化了SiF核的表面粗糙度,显著增强了摩擦电势,提升了发光强度和ROS生成。密度泛函理论(DFT)计算进一步阐明了接触电致发光的机制,即SiF与MnL之间的电子转移和重组,促进了发光过程。
3. 体外血栓靶向与溶栓评价
在体外实验中,SiF@MnL/C6-C NPs在剪切应力作用下表现出显著的血栓靶向性和溶栓效果。荧光成像和共聚焦激光扫描显微镜(CLSM)观察显示,NPs在20分钟内迅速积累在血栓部位,并发射出强烈的荧光信号,实现了血栓的实时成像。溶栓实验表明,SiF@MnL/C6-C NPs的溶栓效率随浓度和剪切应力的增加而显著提高,100分钟内溶栓率达到85.8%,显著高于其他对照组。
扫描电子显微镜(SEM)观察进一步证实了SiF@MnL/C6-C NPs对血栓纤维蛋白网络的破坏作用。与游离的尿激酶型纤溶酶原激活剂(uPA)相比,SiF@MnL/C6-C NPs在相同条件下表现出更高的溶栓效率和更低的出血风险,显示出其作为靶向溶栓剂的巨大潜力。
4. 体内血栓成像与溶栓治疗
在大鼠颈动脉血栓模型中,SiF@MnL/C6-C NPs通过静脉注射后迅速积累在血栓部位,并发出强烈的荧光信号,实现了血栓的实时成像。多普勒超声和激光散斑对比成像(LSCI)监测显示,SiF@MnL/C6-C NPs治疗显著恢复了血流,24小时内血流速度恢复至正常水平的94.6%,血栓狭窄率降低至7.16%。
组织学分析和酶联免疫吸附试验(ELISA)进一步验证了SiF@MnL/C6-C NPs的溶栓效果和生物安全性。治疗后,血栓残留蛋白显著减少,D-二聚体水平显著升高,表明纤维蛋白的广泛降解。同时,血液学参数和肝肾功能指标未发生显著变化,表明NPs具有良好的生物相容性和低毒性。
5. 治疗安全性评估
溶血实验、细胞毒性实验和血小板激活与聚集实验表明,SiF@MnL/C6-C NPs在体外实验中表现出良好的生物相容性,对红细胞、内皮细胞和巨噬细胞的毒性极低。体内治疗安全性评估显示,NPs治疗未引起显著的出血风险、肝肾功能损伤或炎症反应,表明其作为靶向溶栓剂的安全性。
长期毒性观察显示,SiF@MnL/C6-C NPs在21天的观察期内未引起大鼠体重下降或主要器官的病理变化,进一步证实了其生物安全性。
四、总体结论
本研究成功开发了yolk-shell结构的SiF@MnL/C6-C NPs,实现了剪切应力触发的摩擦发光成像与摩擦催化-PDT协同溶栓。该策略通过内源性剪切应力激活NPs,在血栓部位产生靶向性的发光信号和高效的ROS生成,实现了血栓的实时成像和有效溶栓。碱性蚀刻优化表面粗糙度显著增强了摩擦电势,提升了发光强度和ROS生成,进一步提高了诊疗效果。
SiF@MnL/C6-C NPs作为一种靶向、安全、高效的溶栓剂,在血栓性疾病的诊疗中具有广阔的应用前景。未来研究可进一步探索其在其他血管疾病中的潜在应用,并优化NPs的设计和制备工艺,以提高其临床转化潜力。
五、图文概览
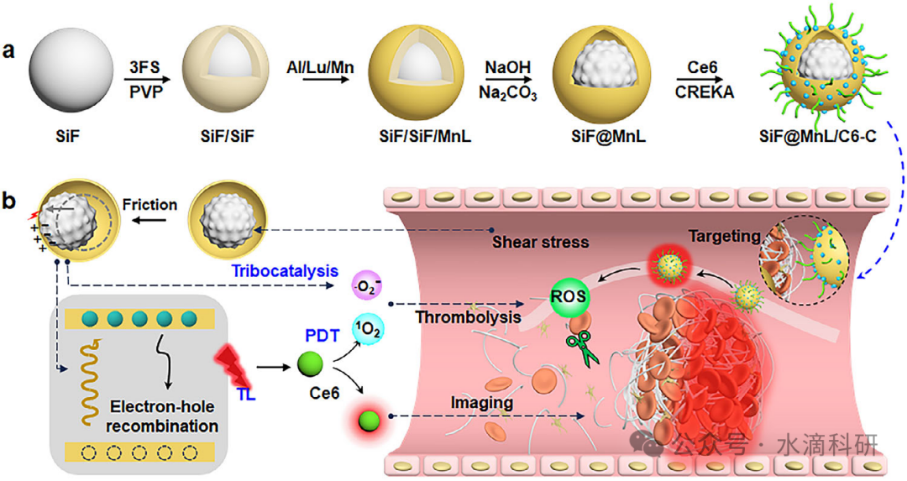
Scheme 1、SiF@MnL/C6-C NPs的制备过程及诊疗机制。
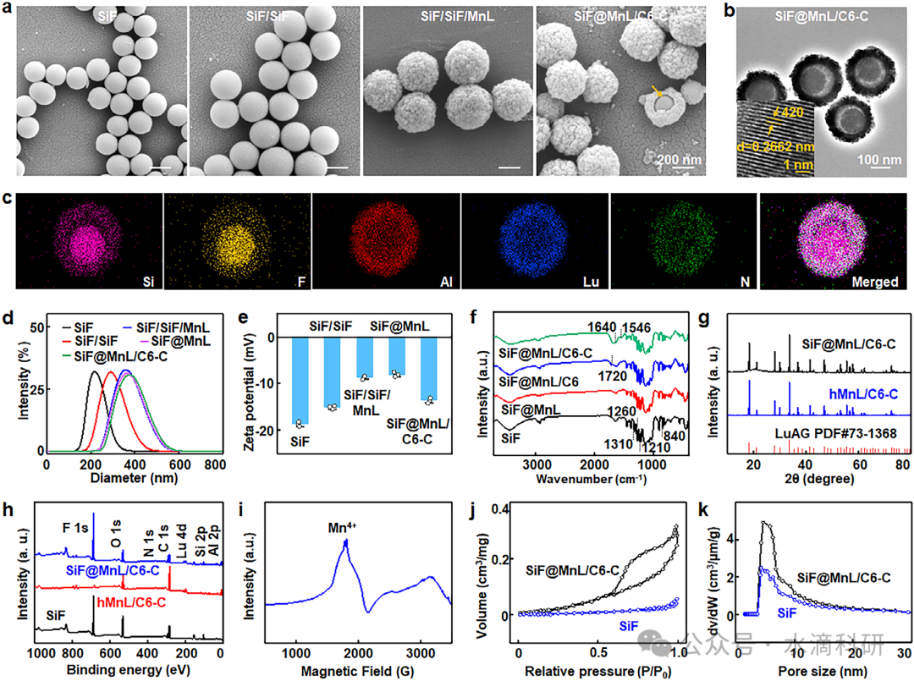
图1、(a) SiF@MnL NPs制备过程中的形态演变。(b) SiF@MnL/C6-C NPs的TEM图像,显示清晰的yolk-shell结构。(c) SiF@MnL/C6-C NPs的元素映射图像。(d) NP制备过程中的水合粒径变化。(e) SiF、SiF/SiF、SiF@MnL和SiF@MnL/C6-C NPs的Zeta电位分析。(f) SiF、SiF@MnL、SiF@MnL/C6和SiF@MnL/C6-C NPs的FTIR光谱。(g) hMnL和SiF@MnL/C6-C NPs的XRD图谱。(h) SiF、hMnL/C6-C和SiF@MnL/C6-C NPs的XPS宽扫描光谱。
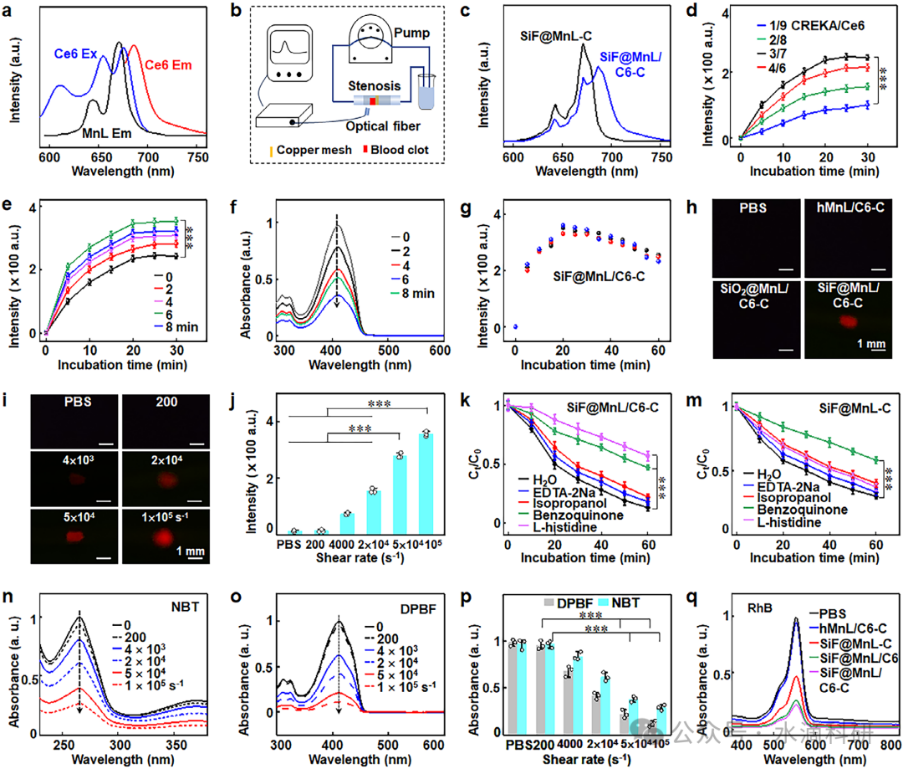
图2、SiF@MnL/C6-C NPs的发光和摩擦催化性能。(a) Ce6和MnL NPs的激发和发射光谱。(b) 用于评估剪切应力诱导的发光和ROS生成的闭环流动系统示意图。(c) SiF@MnL/C6-C处理后血块的时序发光。(d) 不同剪切速率下血块的发光图像。(e) 通过DPBF分解定量ROS生成。(f) 蚀刻时间对ROS生成的影响。(g-i) 剪切应力依赖的发光和ROS生成。(j) 剪切应力依赖的发光强度定量分析。(k) 通过清除实验确定的主要氧化物种。(l-m) ROS生成机制。(n-o) 不同剪切速率下NBT和DPBF的降解。(p) NBT和DPBF降解的定量分析。
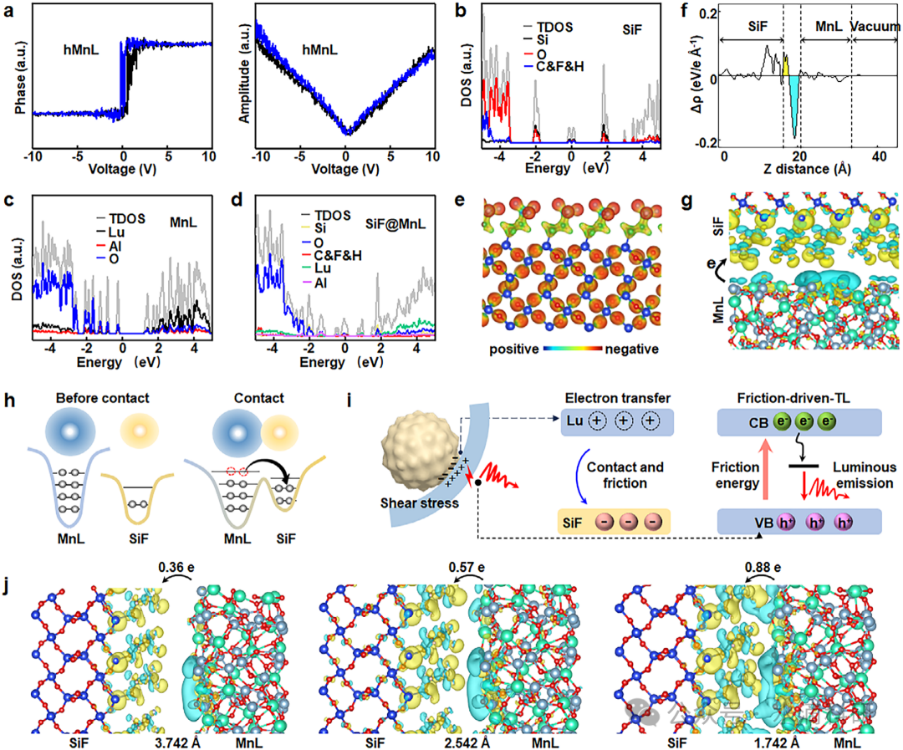
图3、SiF@MnL/C6-C NPs的TL机制。(a) hMnL NPs的PFM相位和振幅。(b-d) SiF、MnL和SiF@MnL的DOS。(e) SiF的ESP。(f) SiF@MnL的平面平均电荷密度差和(g)差分电荷密度图。(h) 接触电致发光机制和(i) 接触诱导的TL机制。(j) 不同距离下SiF与MnL之间的Bader电荷。
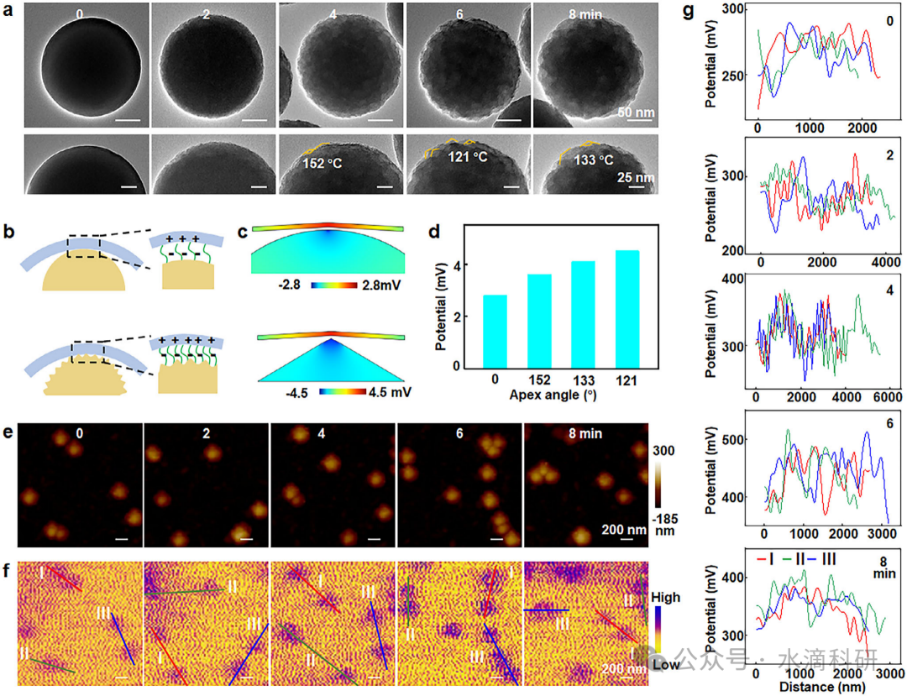
图4、表面粗糙度对接触电致发光的影响。(a) 蚀刻后SiF核的TEM图像和顶角。(b) 粗糙SiF表面增强电子转移的示意图。(c) 光滑和高曲率表面SiF核的电位模拟图像。(d) 不同顶角下SiF表面的电位值模拟。(e-g) 蚀刻后SiF核的地形图、KPFM图像和表面电位分布。
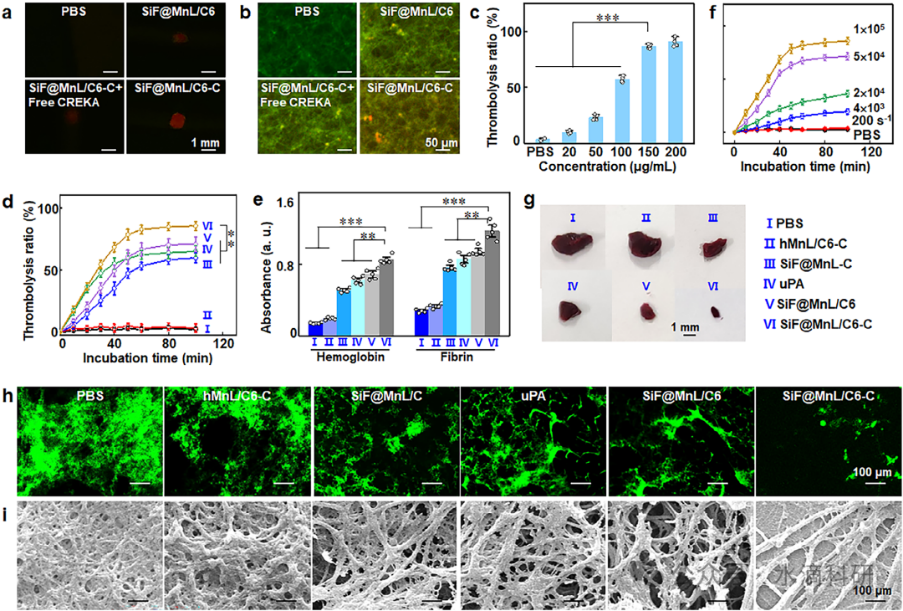
图5、SiF@MnL/C6-C NPs的体外血栓靶向和溶栓。(a) 与SiF@MnL/C6、SiF@MnL/C6-C和SiF@MnL/C6-C+Free CREKA孵育后纤维蛋白的发光图像和(b)荧光共定位。(c) 不同浓度下SiF@MnL/C6-C NPs的溶栓率。(d) 溶栓率和(e) 血块中血红蛋白和纤维蛋白释放的吸光度变化。(f) 不同剪切速率下SiF@MnL/C6-C NPs的溶栓率。(g-i) 不同处理后FITC标记的纤维蛋白血块的血块、CLSM和SEM图像。
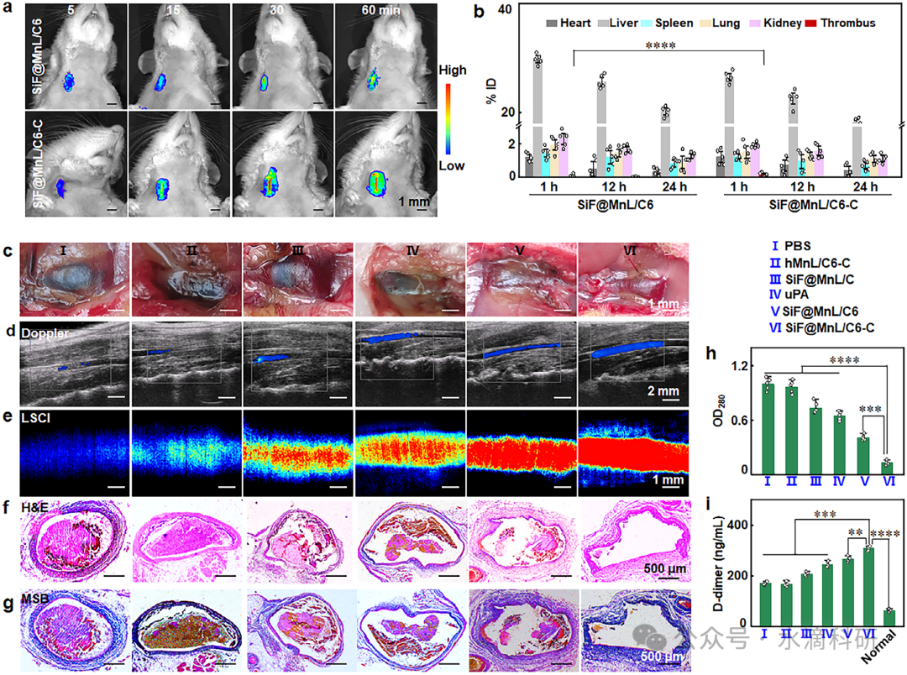
图6、SiF@MnL/C6-C NPs的体内血栓成像和溶栓。(a) 静脉注射SiF@MnL/C6和SiF@MnL/C6-C NPs后颈动脉血栓的荧光图像。(b) 不同组织中的NP积累水平。(c-e) 多普勒超声和LSCI监测的血流恢复情况。(f-h) 残留血栓蛋白和D-二聚体水平。(i) 血液相容性及肝肾功能。
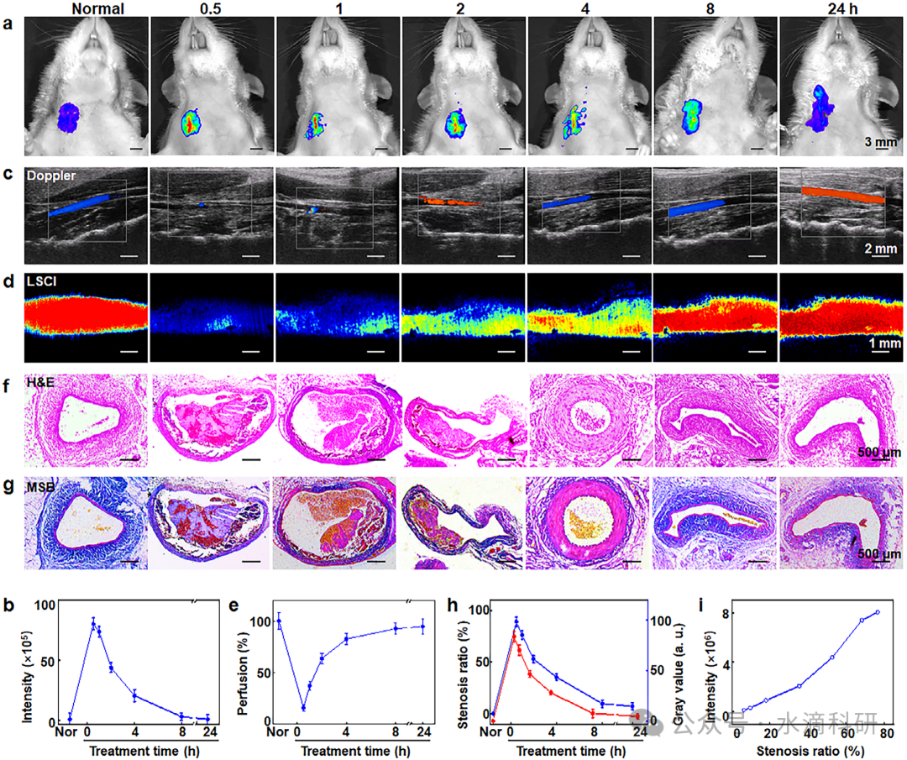
图7、SiF@MnL/C6-C NPs的治疗安全性。(a) SiF@MnL/C6-C NPs的溶血比和(b)细胞毒性。(c) 血小板激活和聚集实验。(d-e) HUVECs和RAW264.7巨噬细胞的活/死染色。(f) 出血时间和出血量。(g-i) 肝肾功能指标和血液学参数。(j) 主要器官的H&E染色图像。
六、作者信息
作者姓名:
Huan Zheng, Wenxiong Cao, Kang Zhang, Pan Ran, Shijun Yang, Tianyu Gao, Xiaohong Li*
通讯作者及单位信息:
Xiaohong Li*
Institute of Biomedical Engineering, College of Medicine, Key Laboratory of Advanced Technologies of Materials, Ministry of Education, Southwest Jiaotong University, Chengdu 610031, P.R. China
七、论文链接
https://advanced.onlinelibrary.wiley.com/doi/10.1002/adfm.202522684