
DOI:https://doi.org/10.1093/rb/rbae089
摘要
西南交通大学陈俊英教授团队研究成果:本研究将激活肝X受体(LXR)激动剂(GW3965)负载于材料表面,通过原位递送至动脉粥样硬化巨噬细胞,提高抗动脉粥样硬化治疗的药物利用效率和斑块消退效能。LXR激动剂通过多通路调控巨噬细胞从而抑制斑块发展,包括脂质代谢(ABCA1、ABCG1及低密度脂蛋白受体)、巨噬细胞迁移(CCR7)和胞葬作用(MerTK)。LXR激动剂负载材料显著减轻动脉粥样硬化模型大鼠的斑块负荷,且未引发肝毒性及材料植入后的血管再狭窄和血栓形成等不良反应。体内外评估均验证其抗动脉粥样硬化能力及生物安全性。该研究揭示:兼具病理微环境调控作用的多功能LXR激动剂负载材料有望成为抗动脉粥样硬化的理想候选材料,在心血管器械表面工程领域具有潜在应用价值。
研究内容简介
一、介绍
心血管疾病发病率和死亡率的持续攀升已成为重大公共卫生问题。临床上,经皮冠状动脉介入治疗(PCI)是除药物治疗与外科手术外最有效的动脉粥样硬化(AS)干预手段,但受限于支架植入后支架内血栓形成、支架内再狭窄(ISR)(如新发AS)等并发症,其治疗效果尚存局限。针对心血管介入材料生物相容性不足的问题,研究者筛选了功能分子、基质蛋白、抗体及特异性因子等多种生物分子用于器械表面工程,通过分别或同步调控材料表面的血液相容性与细胞相容性,赋予表面抗凝、抗再狭窄及内膜修复能力。然而,当前研究所选用的微环境、评价细胞及体内植入部位通常处于正常生物状态,与AS斑块病变部位的细胞行为及特征存在显著差异。实际应用中,这些生物分子的调控作用会受到病理血管微环境影响。此外,结合器械植入部位的AS斑块特征,关于巨噬细胞行为及胆固醇分子调控的研究仍较为匮乏。因此,本研究旨在探索在器械材料表面构建斑块适应性病理微环境,并利用该微环境对斑块进行原位干预,从而调控细胞分子生物学行为并促进斑块消退。
AS是一种以血管内膜下脂质蓄积与炎性细胞浸润为特征的慢性炎性血管病变,本质是巨噬细胞功能障碍引发的长期发展过程。巨噬细胞是斑块中丰度最高的细胞,其可通过加剧局部炎症反应、诱导巨噬细胞源性泡沫细胞在AS病变部位积聚,推动AS持续发展。更重要的是,易损斑块中巨噬细胞的高度浸润会显著增加斑块破裂风险。值得注意的是,巨噬细胞是调控脂质平衡的核心要素,斑块可能随脂质含量变化及巨噬细胞作用而呈现消退或进展两种转归。巨噬细胞内游离胆固醇的持续蓄积会引发内质网应激,诱导炎症反应并最终导致细胞凋亡,而凋亡小体若无法被有效清除则可能加速AS进程。总体而言,巨噬细胞内脂质蓄积会导致其功能紊乱,影响抗炎、免疫及脂质代谢功能。Liu等采用多酶共表达纳米药物通过胆固醇耗竭策略破坏脂筏完整性,该团队还通过胆固醇耗竭减轻细胞内质网应激,从代谢层面打破免疫抑制微环境并重塑免疫细胞功能。
因此,减少巨噬细胞内胆固醇蓄积有望成为治疗并逆转AS的有效策略。目前,他汀类药物降脂治疗已在临床取得成功,促进斑块胆固醇外流的研究也在持续推进,但多局限于非支架治疗的药物靶向方案,存在药物递送与斑靶向的技术挑战。研究证实,支架植入后早期血栓形成与急性炎症反应并存,且内膜损伤与脂质核心渗透会进一步加剧炎症,提示脂质蓄积与炎性细胞浸润在ISR发展中具有重要作用。
树状大分子因其可控的纳米级结构、内部大量疏水空腔及表面高密度阳离子官能团等特性备受关注。从作用机制看,功能分子与树状大分子的结合驱动力主要包括:表面官能团与分子间的静电吸附及共价反应、树状大分子空腔与分子间的疏水作用、树状大分子内核叔胺基团与分子间的氢键作用。树状大分子作为独特载体可耦联多种功能分子,在生物医学领域具有特殊应用价值。前期研究表明,聚酰胺-胺型(PAMAM)树状大分子凭借良好生物相容性成为理想载体选择。
肝X受体(LXRs)(包括LXRα和LXRβ)属于配体激活的核激素受体超家族转录因子,因其在调控胆固醇稳态、炎症消退及胞葬作用等方面的多功能性,已成为AS治疗的重要靶点。LXRs激活后可调控ABCA1和ABCG1的基因表达,二者在胆固醇逆转运(RCT)中发挥关键作用:LXRs通过ABCA1和ABCG1将游离胆固醇转运至肝脏,随后通过ABCG5和ABCG8促进肝胆固醇向胆汁酸排泄并减少肠道吸收,因此对抑制泡沫细胞形成及治疗AS具有指导意义。在巨噬细胞层面,Wang等发现LXR信号激活可促进胆固醇向HDL外流,Sorrentino等证实当巨噬细胞脂质蓄积时,LXR激活可负调控泡沫细胞形成,展现出潜在抗AS治疗价值。Zanotti等与Wang等进一步在体内验证了LXR刺激对组织细胞向粪便胆固醇RCT的促进作用,从而实现胆固醇排泄与血脂水平降低。除脂质调控外,炎症反应在AS进展中同样具有重要作用。LXR激活除促进胆固醇外流外,还可通过抑制炎症基因表达影响AS进程。研究还发现,LXR缺陷小鼠中ABCA1基因表达下调的同时,Mer酪氨酸激酶(MerTK)基因表达也受到抑制;LXR激活后,凋亡细胞通过LXR依赖性途径诱导MerTK逆转胞葬作用缺陷,从而实现凋亡细胞清除与炎症消退。由此可见,LXR激动剂可能通过增强胆固醇外流与改善胞葬作用发挥协同抗AS效应。另一方面,巨噬细胞还可通过迁移途径清除斑块胆固醇。斑块内泡沫细胞数量取决于细胞募集、原位增殖、迁移及死亡动态平衡。既往AS进展研究多关注单核细胞在血管壁的积聚机制及其阻断策略,但新近研究表明,决定巨噬细胞滞留与迁出斑块的其他因素可导致巨噬细胞数量与胆固醇含量减少,进而实现AS消退。多项证据表明,LXR是CCR7表达与功能的调控因子,其通过刺激斑块中CD68+细胞(巨噬细胞与泡沫细胞标志物)迁移发挥动脉保护作用。目前,LXR激动剂的开发已投入大量研究,部分药物虽进入临床试验,但均因不良事件终止。GW3965与T0901317作为两种广受关注的LXR激动剂,可有效诱导LXRα和LXRβ靶基因在体内外表达。尽管LXR激活对AS具有积极作用,但LXR激动剂系统给药达到有效剂量时会引起肝脂肪变性、高甘油三酯血症等肝脏副作用,严重阻碍其临床转化。综上所述,通过LXR激动剂功能化修饰植入材料以实现病灶部位原位靶向调控,是操纵LXRs及其靶点的必要途径。
本研究采用LXR激动剂GW3965在材料表面构建生物活性修饰涂层,以调控脂质含量并抑制AS斑块进展。功能材料构建首先通过静电作用将PAMAM固定于碱活化钛表面形成富胺基表面,随后通过共价与非共价结合双重策略将GW3965引入表面,在提高表面固定量的同时实现GW3965的缓释效应。如图1所示,该材料可将LXR激动剂原位特异性递送至AS巨噬细胞。GW3965可作用于巨噬细胞激活LXR,最终通过增强胆固醇外流与抑制炎症反应,恢复与胆固醇负荷升高相关的巨噬细胞泡沫细胞迁移功能。此外,LXR激活还可上调与胞葬作用相关的MerTK基因表达,解决AS中凋亡细胞清除缺陷问题。最后,通过体外病理环境模拟高脂细胞模型功能测试、体内安全性评估及AS模型大鼠体内抗AS疗效评价等一系列系统验证,证实了该材料的安全性与有效性。
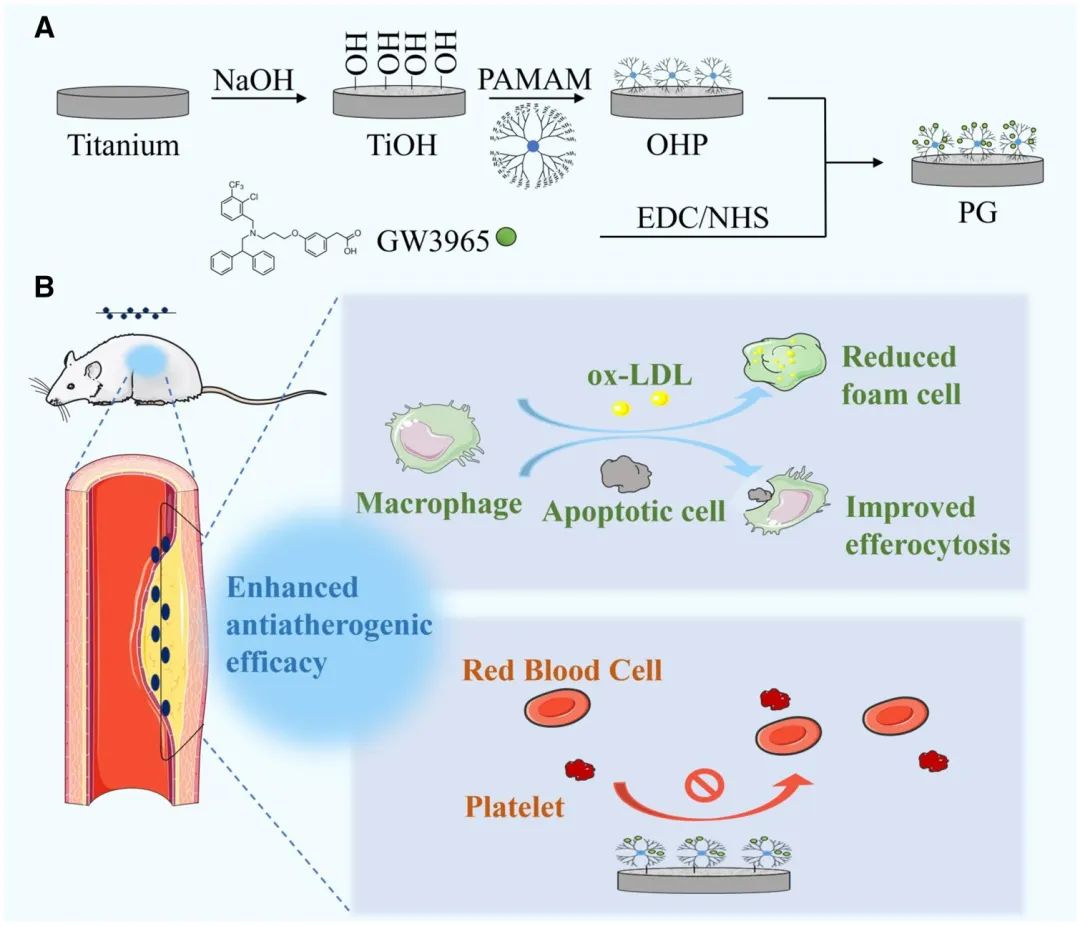
图1 调控巨噬细胞功能并干预动脉粥样硬化进展的表面修饰材料设计示意图。(A)负载肝X受体激动剂的修饰材料构建原理;(B)动脉粥样硬化治疗机制简图。
二、结果
(一)样品的制备与表征
通过碱热处理获得的钛表面电负性可通过静电作用自发吸附PAMAM树状大分子,经PAMAM修饰形成的富胺基表面可进一步通过共价键、静电作用及疏水相互作用负载LXR激动剂GW3965。采用ATR-FTIR分析改性材料表面官能团组成(图2A),结果显示:3230 cm⁻¹处的宽强峰归属于TiOH中O–H键的振动;约1640 cm⁻¹处的吸收峰对应OHP与PG中C=O的伸缩振动;1560 cm⁻¹处的N-H键振动峰表明胺基存在。GW3965特征峰(C-F键1319 cm⁻¹、C-N键1138 cm⁻¹及C-Cl键1086 cm⁻¹)的出现证实其成功固定于钛表面。
XPS全谱分析(图2B)显示:所有样品均存在Ti 2p(456 eV)、C 1s(284.8 eV)、N 1s(398.4 eV)及O 1s(532 eV)特征峰;GW3965接枝后新增F 1s(685.7 eV)与Cl 2p(199.8 eV)峰,表明氟、氯元素引入。与OHP相比,PG材料F元素峰面积显著增加(图2C)。GW3965负载后,N元素含量从10.33%降至4.25%,而F、Cl含量分别升至8.82%和1.89%(附表S1)。
酸橙II法测定胺基密度(图2D)显示:不同GW3965浓度负载形成梯度胺基表面。Ti/TiOH组胺基密度最低,OHP组最高达39 nmol/cm2,PG100、PG300与PG500组胺基密度依次递减至33、29和28 nmol/cm2。释放30天后,胺基密度仍保持相同趋势(附图S1)。通过紫外分光光度法(λ=271 nm)检测溶液中GW3965含量,经差值法计算表面接枝量。如图2E所示,PG100、PG300与PG500组GW3965密度分别为6、14和16 nmol/cm2。体外药物释放实验(图2F)表明:各组材料在PBS中释放趋势相似,前2天快速释放达35%以上,3-7天释放速率减缓,10天后趋于平衡,累计释放率均超90%。综上,GW3965修饰材料具有一定稳定性,可实现药物缓释,有利于提高药物利用率。
SEM表征材料表面形貌(图2G)显示:碱活化处理使钛表面形成层状多孔结构,不仅增加表面粗糙度,同时提供高密度羟基位点与负电荷。PAMAM修饰后,无序致密微孔结构更加均匀,这可能是由于PAMAM的引入降低了表面粗糙度所致。GW3965固定后,材料表面孔径介于TiOH与OHP之间,呈现致密化特征。接触角测试(附图S2)表明:碱活化处理使表面水接触角从63°降至17°,PAMAM修饰后进一步降低至11°。
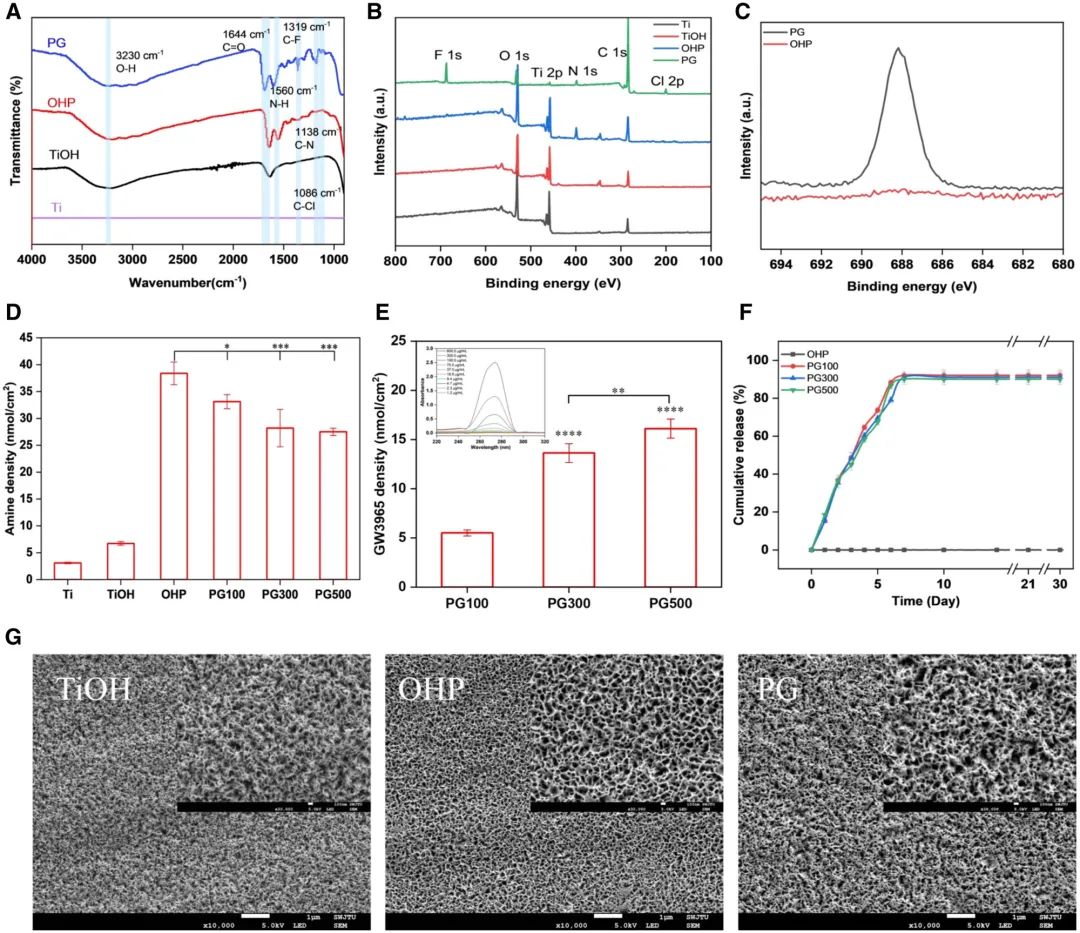
图2 材料表征结果。(A)FTIR光谱;(B)XPS全谱扫描及(C)F元素高分辨谱图;(D)材料表面胺基密度;(E)GW3965负载密度定量分析;(F)不同时间点GW3965累计释放曲线;(G)各样品SEM形貌图(均值±标准差,N=3;*P < 0.05,**P < 0.01,***P < 0.001,****P < 0.0001)。
(二)材料对巨噬细胞及oxLDL刺激巨噬细胞的影响
巨噬细胞作为动脉粥样硬化斑块中最早出现的细胞成分,是斑块形成与炎症反应的关键标志。在持续炎症刺激下,巨噬细胞通过参与脂质代谢、分泌炎症因子及形成泡沫样细胞,最终可能演变为凋亡或坏死细胞。因此,探究材料对巨噬细胞生物学行为的影响至关重要。本研究通过oxLDL体外刺激巨噬细胞模拟泡沫细胞形成。油红O染色显示,泡沫细胞内脂质被特异性染红(图3A);吸光度定量分析表明其脂质相对含量显著高于普通巨噬细胞(图3B)。活死细胞染色与活性检测进一步证实,模型组出现明显死细胞,且细胞活性降低约40%(图3C-D)。随着oxLDL浓度增加,巨噬细胞活性逐渐下降,胞内脂质蓄积及活性氧(ROS)水平同步升高(附图S3),表明体外细胞模型构建成功。
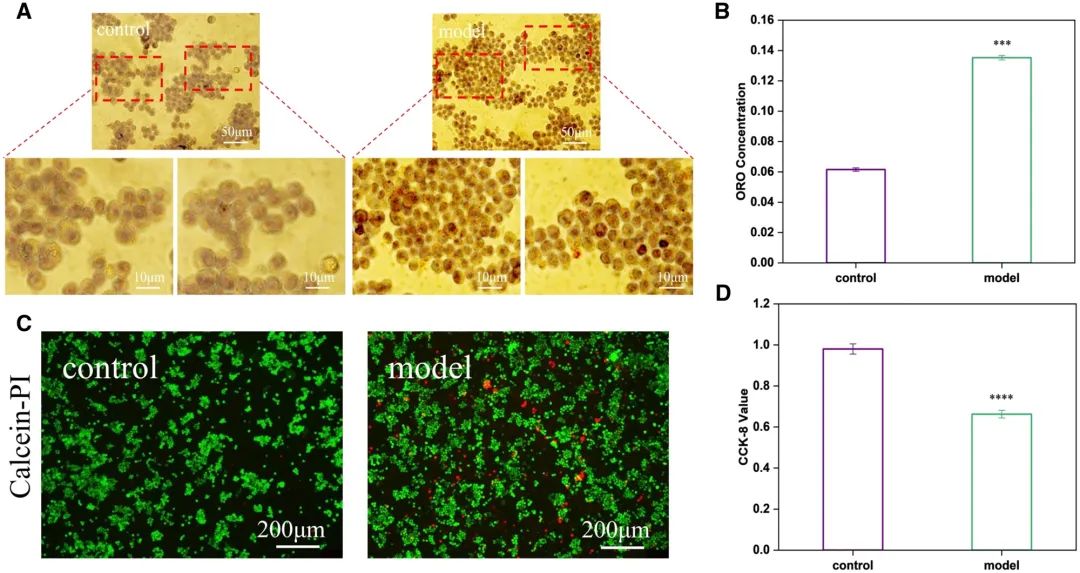
图3 体外构建泡沫细胞模型。(A)明场下细胞内脂质染色结果;(B)脂质相对含量分析;(C)活死细胞Calcein-PI荧光染色显微图像;(D)细胞活性定量(均值±标准差,N=3;***P < 0.001,****P < 0.0001)。
泡沫细胞与普通巨噬细胞在细胞表型、炎症水平、脂质代谢及ROS水平等分子层面存在显著差异。本研究通过将巨噬细胞及模型细胞接种于材料表面,系统评估材料对泡沫细胞功能的调控作用。活死细胞双染色(Calcein-PI法)结果显示:普通巨噬细胞各组均无明显死细胞,但活细胞覆盖率存在差异(图4A);材料表面细胞活性较对照组降低(图4B),其中GW3965组细胞黏附量显著低于其他组,OHP组细胞覆盖率分别为PG100、PG300与PG500组的1.2、1.3及1.9倍(图4C)。模型细胞实验结果(图4D-F)表明:GW3965可有效降低泡沫细胞活性并抑制其黏附,且不同浓度组间无显著差异。综上,GW3965能有效抑制体外炎症巨噬细胞增殖,其效应具有浓度非依赖性。
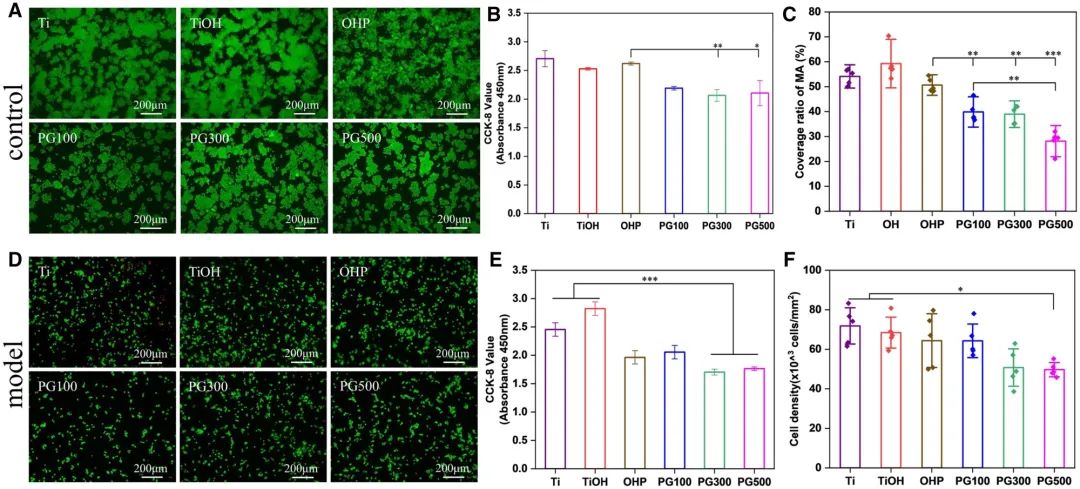
图4 材料的细胞相容性。(A、D)巨噬细胞与泡沫细胞荧光显微图像;(B、E)CCK-8细胞活性检测结果;(C、F)两种细胞黏附数量定量分析(均值±标准差,N=3;*P < 0.05,**P < 0.01,***P < 0.001)。
(三)体外抗炎、抗氧化、抗泡沫细胞形成及胞葬作用评估
M1型巨噬细胞通过分泌促炎因子加速炎症进程,而M2型巨噬细胞则分泌抗炎因子以缓解炎症,其表型极化在动脉粥样硬化中具有重要作用。本研究通过oxLDL刺激诱导巨噬细胞向M1表型转化,并通过流式细胞术分析材料对巨噬细胞极化的影响。结果显示(图5A与C),与OHP组相比,GW3965修饰材料显著降低M1型巨噬细胞比例(PG100、PG300与PG500组M1阳性率分别为27%、30%与31%)。而M2型巨噬细胞比例虽略有升高,但各组间无显著差异(图5B、D-E)。通过ELISA试剂盒检测M1型巨噬细胞分泌的TNF-α及M2型分泌的IL-10水平(图6A-B),发现GW3965可显著下调TNF-α分泌(抑制率>50%),但对IL-10无显著影响,与FCM结果一致,表明GW3965通过减少M1型巨噬细胞数量并抑制促炎因子释放发挥抗炎作用。鉴于oxLDL的氧化特性,本研究进一步评估材料的抗氧化活性。通过DHE探针标记ROS,结果显示红色荧光强度与ROS水平正相关;同时检测SOD活性进行定量分析(图6C-D)。与对照组相比,PG100、PG300与PG500组的SOD活性分别提高约1.1倍、1.2倍与1.3倍,其中PG300组的抗氧化效果最为显著。
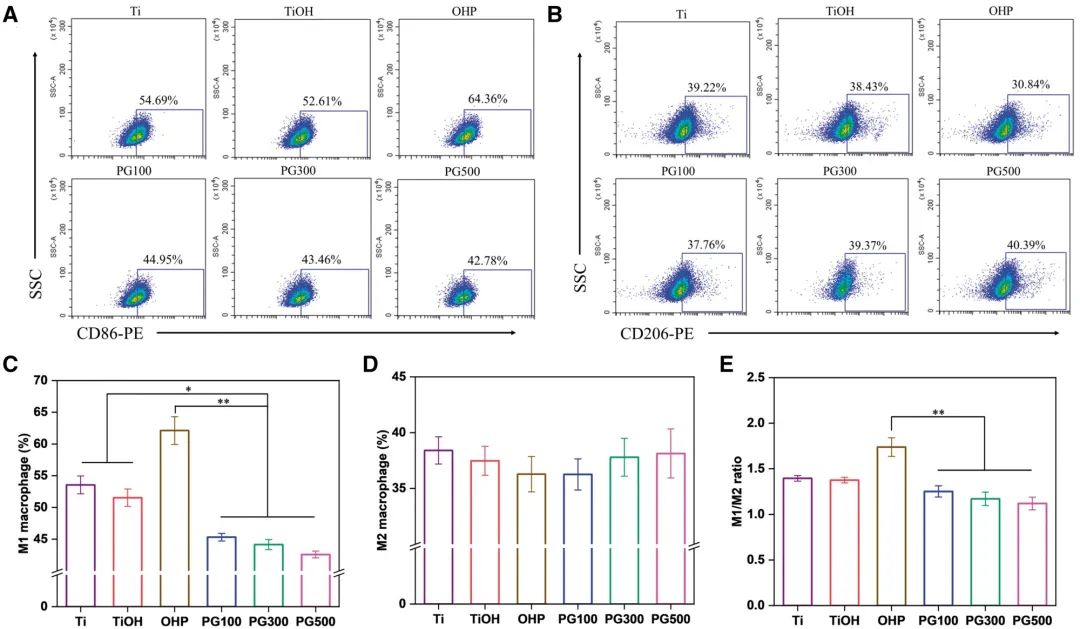
图5 不同材料对体外巨噬细胞极化的影响。(A、B)流式细胞术分析(A)CD86+标记的M1型及(B)CD206+标记的M2型巨噬细胞比例;(C)CD86+与(D)CD206+阳性细胞百分比;(E)M1/M2极化比值(均值±标准差,N=3;*P < 0.05,**P < 0.01)。
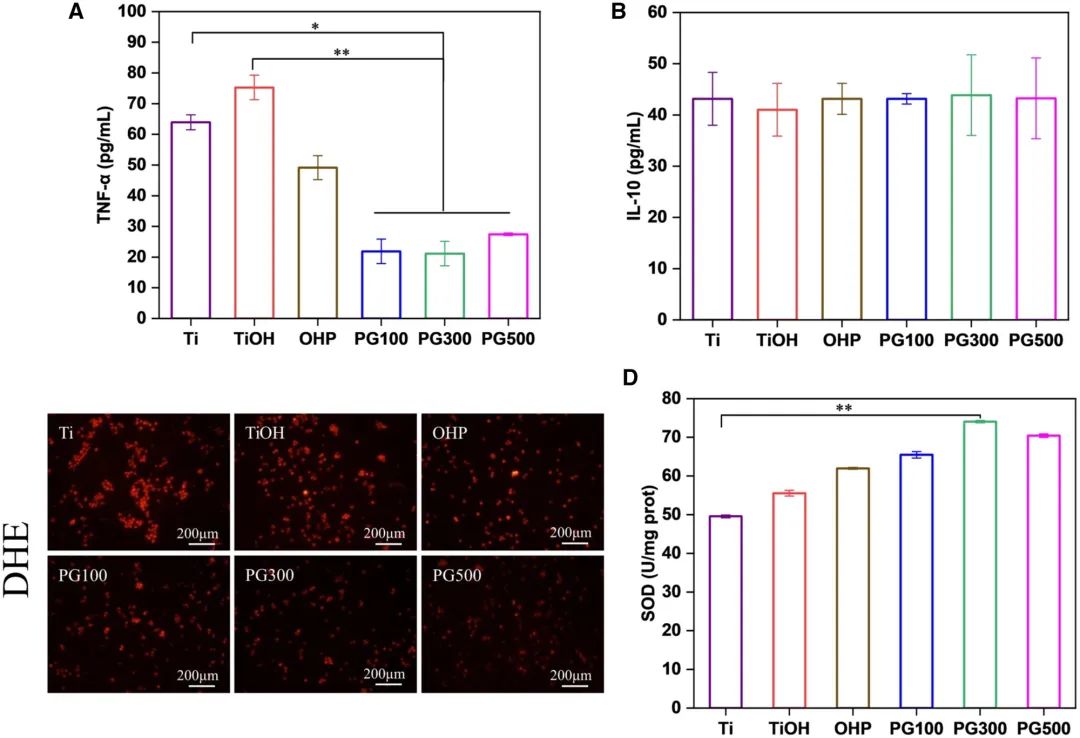
图6 不同材料共培养后细胞内炎症因子与ROS水平表征。(A)TNF-α细胞因子含量;(B)IL-10细胞因子含量;(C)DHE标记ROS荧光染色图像;(D)SOD活性检测(均值±标准差,N=3;*P < 0.05,**P < 0.01)。
巨噬细胞脂代谢失衡导致的脂质蓄积是泡沫细胞形成的关键机制。本研究通过Dil-oxLDL标记胞内脂质(红色荧光),发现GW3965修饰材料可显著降低脂质阳性染色面积(图7A-B),其平均荧光强度依次为Ti>TiOH>OHP>PG100>PG300>PG500组,且PG100、PG300与PG500组的荧光强度分别为Ti组的1/2、1/3与1/5。同时,检测上清液中Dil-oxLDL含量以评估胆固醇外流能力(图7C),发现GW3965可显著促进脂质外排,其中PG300与PG500组的脂质清除效果最为显著且相当。通过试剂盒定量检测胞内总胆固醇(TC)、游离胆固醇(FC)及氧化低密度脂蛋白水平(图7D-F),证实模型组脂质含量为正常巨噬细胞的2倍以上,而GW3965处理组(尤其是PG300与PG500)可显著逆转脂质蓄积,有效抑制泡沫细胞形成。
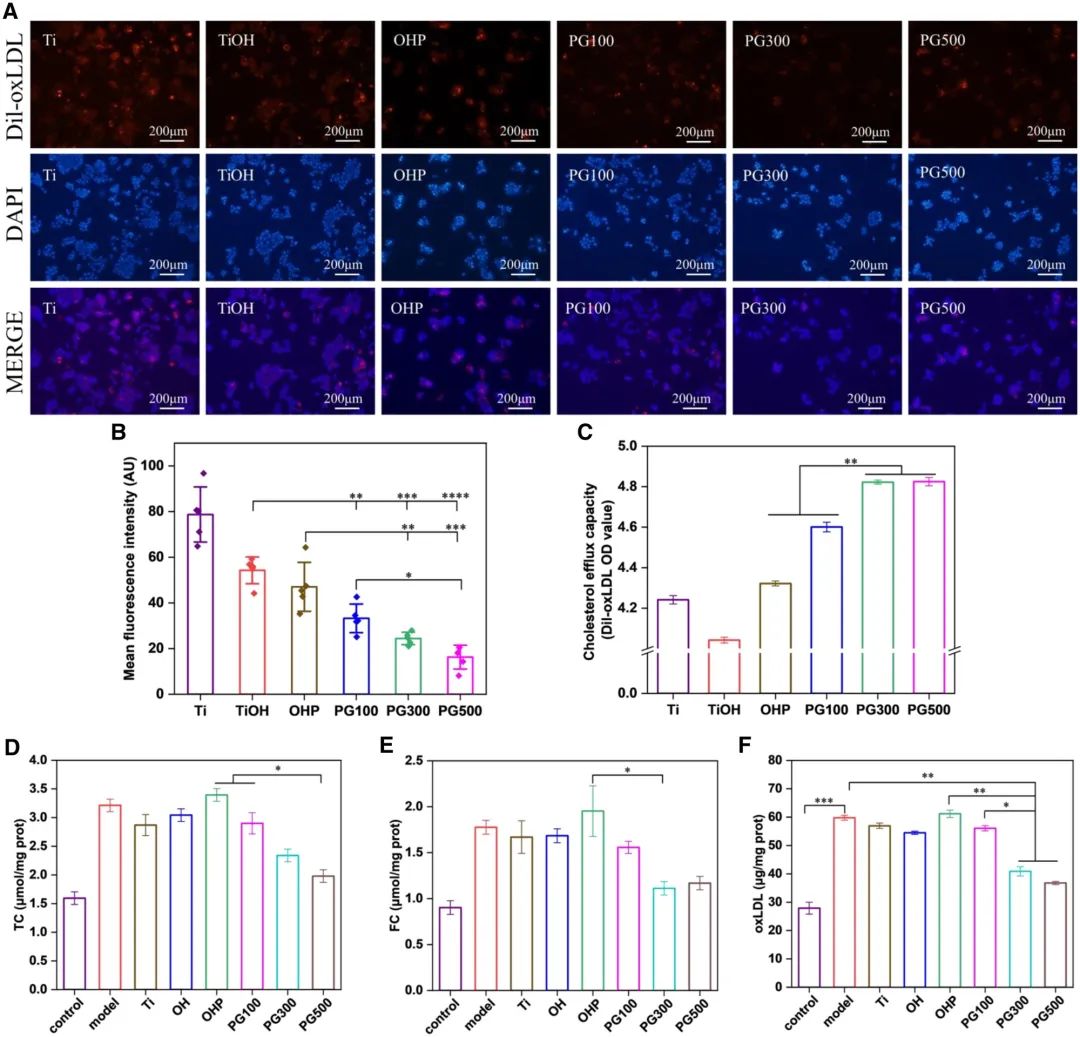
图7 不同材料对细胞内脂质的作用。(A)Dil-oxLDL荧光染色图像;(B)平均荧光强度定量比较;(C)不同样品干预下胆固醇外流效应检测结果;(D-F)巨噬细胞、泡沫细胞及材料处理组细胞内TC、FC与oxLDL含量检测(均值±标准差,N=3;*P < 0.05,**P < 0.01,***P < 0.001,****P < 0.0001)。
针对动脉粥样硬化中巨噬细胞胞葬功能缺陷,本研究采用荧光微球模拟凋亡细胞,观察材料处理后的吞噬能力(图8A)。结果显示,Ti与TiOH组细胞对微球的吞噬数量较少且分布分散,而GW3965修饰材料处理组细胞胞质及膜周可见大量微球聚集。定量分析表明(图8B),PG500组泡沫细胞对微球的内吞能力较OHP组提升约21%。
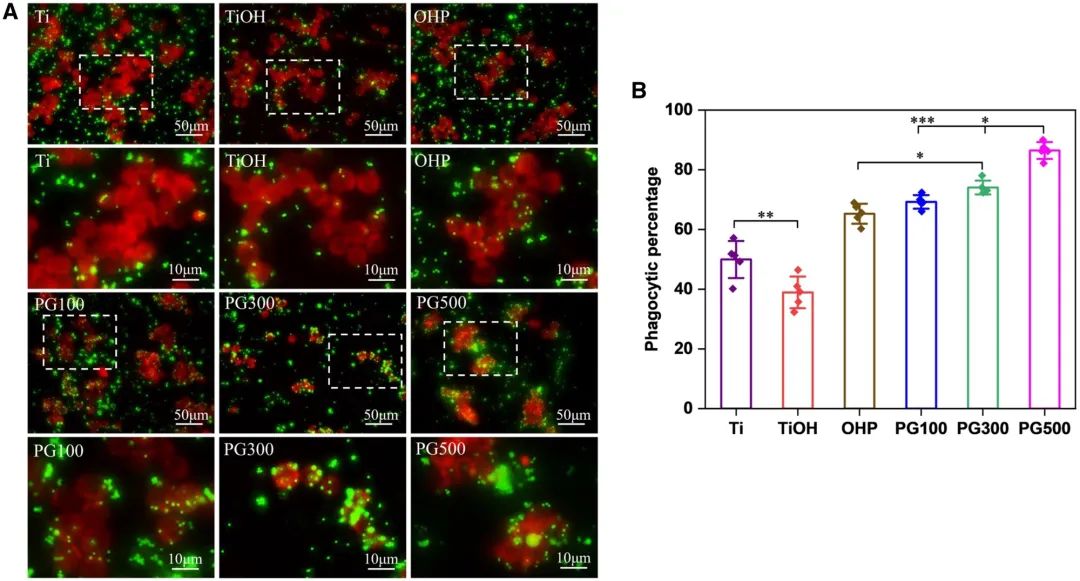
图8 不同材料对吞噬作用的调控效果。(A)样本上与经细胞追踪红 CMTPX 标记的泡沫细胞共同孵育的微球的荧光图像;(B)不同处理组泡沫细胞吞噬功能定量分析结果(均值±标准差,N=3;*P < 0.05,**P < 0.01)。
(四)血液相容性评价
直接接触血液的植入材料需具备优异的血液相容性,以避免血栓形成与溶血反应。本研究通过血小板黏附、溶血试验及动态凝血实验综合评价材料血液相容性。血小板黏附实验显示(图9A-B),Ti与TiOH表面可见大量黏附血小板,其中Ti组血小板呈现伪足延伸与聚集状态,而碱活化的TiOH表面血小板完全铺展,表明其显著激活血小板活性。PAMAM过渡层的引入使血小板黏附数量较Ti对照组降低约37%,且多数血小板保持正常圆形形态。GW3965修饰组血小板黏附抑制效果呈浓度依赖性,较OHP对照组分别降低35%、60%与73%,其中PG300组抗凝活性最为显著。溶血实验表明(图9C),除阳性对照外,所有样品上清液均澄清透明,溶血率均低于5%,符合生物材料安全性标准。体外动态凝血实验通过检测溶液吸光度评估材料抗凝血性能(图9D-E)。结果显示,30 min内除TiOH外,其余样品均表现出良好抗凝效果;30 min后TiOH与Ti组吸光度急剧下降,提示其表面凝血反应加剧。PG300组吸光度变化最小(仅下降0.6),对应溶液颜色最浅,表明其抗凝效果最优。血液凝固指数(BCI)分析进一步证实(图9F),随时间延长,PG300组BCI值始终高于其他组(60 min时达71%),分别为Ti对照组与OHP组的5倍与1.6倍,表明其显著延长凝血时间。为模拟血流环境下的抗血栓性能,开展离体实验(图9G)。将样品卷曲固定于导管内壁,Ti与TiOH组管腔出现明显闭塞,而GW3965修饰组无血栓形成(图9H)。SEM观察显示,Ti与TiOH表面形成致密纤维蛋白网络,并捕获大量活化血小板与红细胞;而GW3965修饰组纤维网络结构不明显,血小板黏附与红细胞捕获显著减少,其中PG300组在60 min内持续展现高效抗血栓能力。
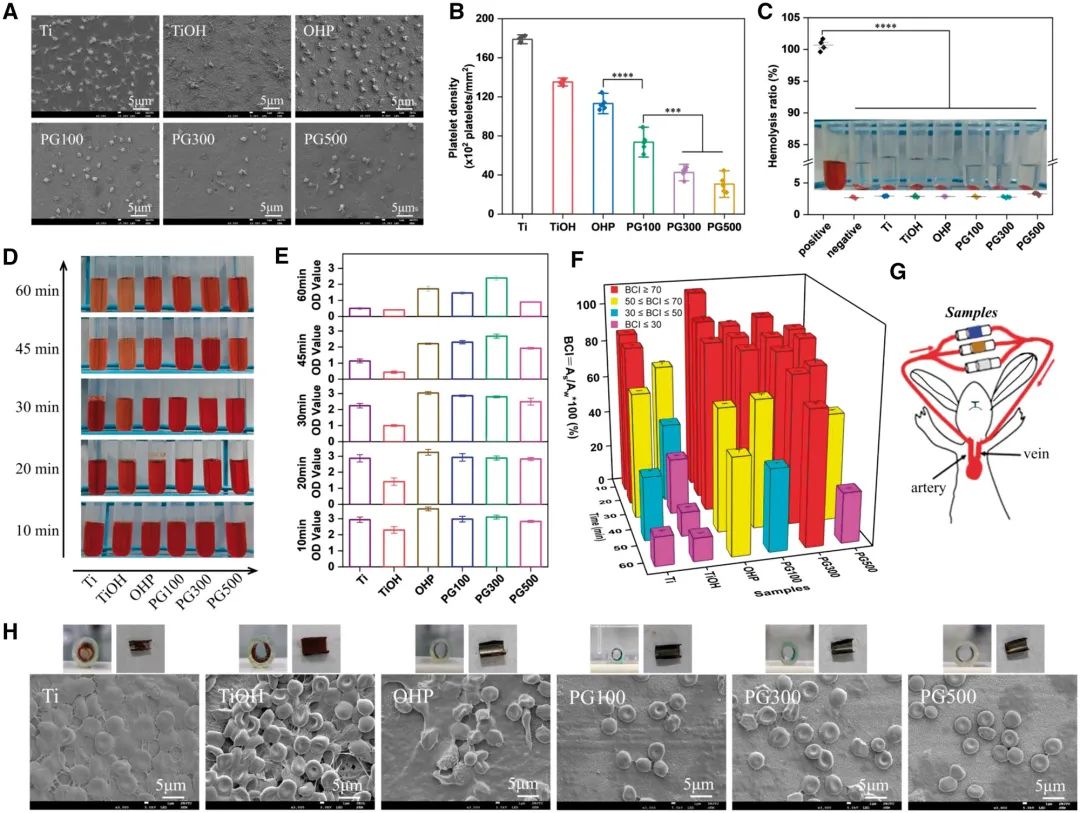
图9 材料的血液相容性。(A)SEM图像;(B)样品血小板黏附数量;(C)不同样品溶血率检测结果;(D)体外动态凝血实验数字图像;(E)吸光度值检测;(F)BCI统计分析;(G)离体模型构建示意图;(H)导管样品横截面图像、展开状态实物照片及动态血液循环30 min后材料表面SEM形貌(均值±标准差,N=3;***P < 0.001,****P < 0.0001)。
综合上述各种样本的体外效果,包括抑制巨噬细胞和泡沫细胞的活性及黏附、减少炎性巨噬细胞的数量、抗凝以及促进胆固醇流出等,结果表明GW3965修饰的材料具有与该药物本身相应的益处,其中PG300的性能最佳(图10)。因此,选择PG300浓度的样本作为实验组,以Ti和OHP作为对照组,来验证体内治疗效果并探索其作用机制。
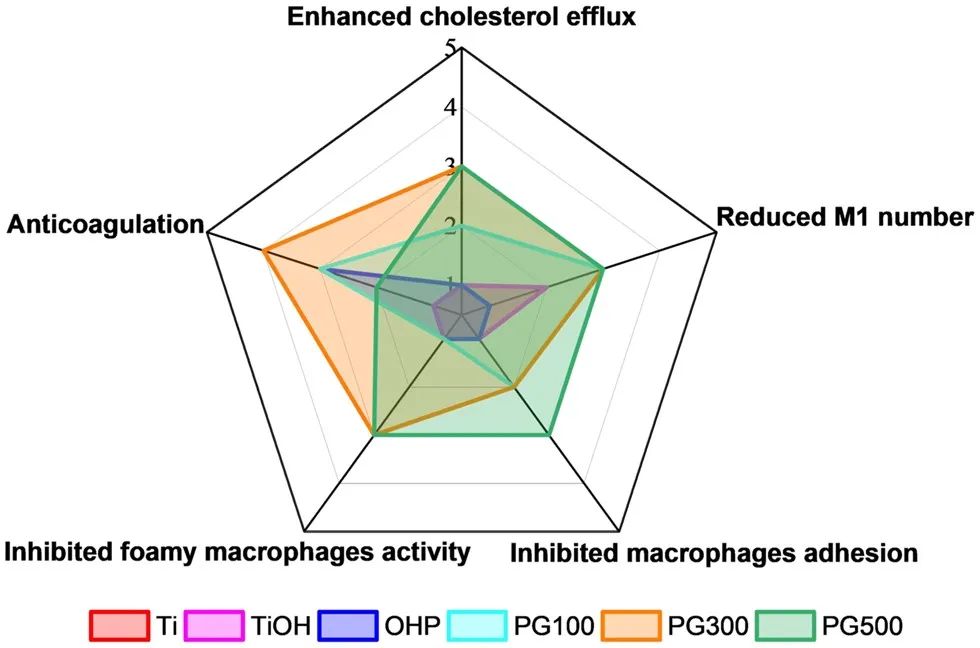
图10 对每个样品体外实验的综合评估。
(五)GW3965修饰材料对泡沫样巨噬细胞mRNA表达的影响
GW3965作为LXR激动剂,可通过调控逆向胆固醇转运关键基因表达发挥抗动脉粥样硬化作用。本研究通过qPCR检测模型泡沫样巨噬细胞中LXR下游靶基因表达水平,以揭示材料促进胆固醇外流的分子机制(图11)。结果显示,PG300组ABCA1基因表达量较模型细胞提升约5倍,ABCG1表达亦轻微上调,表明GW3965显著增强胆固醇向HDL的转运能力。此外,PG300组LDLR基因表达下调,提示其可减少巨噬细胞对胆固醇的摄取。
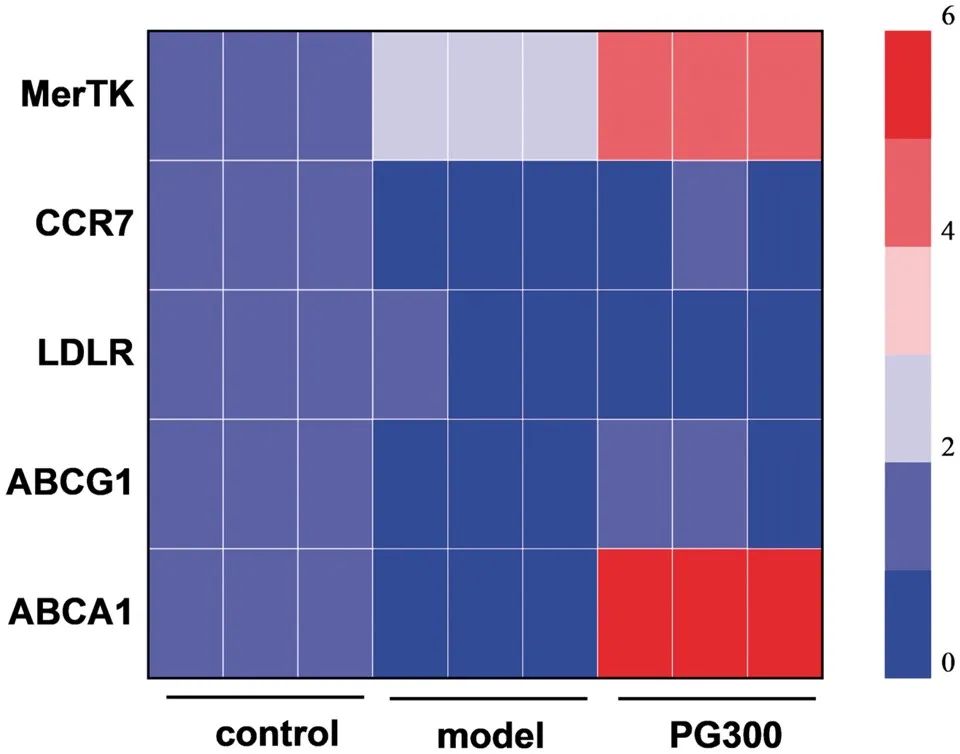
图11 PG300处理后巨噬细胞内ABCA1、ABCG1、LDLR、MerTK、CCR7 mRNA表达的改变。
针对斑块内巨噬细胞迁移能力减弱导致的炎症加剧现象,检测CCR7基因表达发现:GW3965可逆转oxLDL诱导的CCR7表达抑制,从而增强巨噬细胞迁移活性。同时,PG300组胞葬作用关键调控因子MerTK基因表达显著上调,证实该材料可修复斑块区凋亡细胞清除缺陷。上述基因均为LXR信号通路下游靶点,补充实验(附图S4)进一步显示PG300组显著激活细胞内LXR表达。综上,GW3965通过激活LXR信号通路实现多重抗动脉粥样硬化效应:(1)减少脂蛋白摄取并促进胆固醇外排,抑制泡沫细胞形成;(2)加速巨噬细胞迁移,减少炎症细胞蓄积;(3)增强凋亡细胞清除能力,缩小斑块坏死核心。
(六)体内材料植入对动脉粥样硬化治疗的评估
材料植入将异物引入体内,会与血液和血管壁组织相互作用,新生组织会逐渐将植入样本包裹起来。本研究通过将钛丝、经PAMAM修饰的OHP材料以及含有LXR激动剂的PG300样品分别植入SD大鼠腹主动脉,来评估体内材料与组织的相互作用。植入30天后,各组样本均被新生内膜覆盖。图12A中的H&E染色结果显示,在Ti和OHP组新生内膜最内层(虚线圈出区域)有大量炎性细胞聚集,而PG300组未见明显炎症细胞,表明炎症反应较轻。与Ti和OHP相比,PG300组新生内膜厚度分别降低了约49%和60%(图12B),新生内膜面积均降低60%以上(图12C)。此外,PG300组新生内膜中的平滑肌细胞和巨噬细胞较少,导致样本新生内膜增生较少。Ti和OHP组新生内膜中增殖的平滑肌细胞和聚集的炎症反应导致胶原纤维产生增加(图12D-F)。为进一步分析组织中的炎症程度,对巨噬细胞表型进行了特异性染色。促炎巨噬细胞表现为iNOS阳性表达,被染为绿色荧光,通过分泌炎症因子增强周围组织的炎症反应;而抗炎巨噬细胞特异性表达CD206,被染为红色荧光,通过分泌抗炎因子抑制和消除组织炎症。如补充图S5A所示,样本植入周围CD206表达较弱,且iNOS阳性表达不明显,这可能是由于材料未引发严重的炎症反应。也可能部分引发急性炎症,但长期植入后身体会通过自我调节使其消退。通过统计计算(补充图S5B),PG300样本周围M2/M1比值较高,表明M2阳性细胞表达较多,有利于炎症消退。上述结果证实,经GW3965修饰的材料增强了生物相容性,有效抑制了再狭窄的发生。
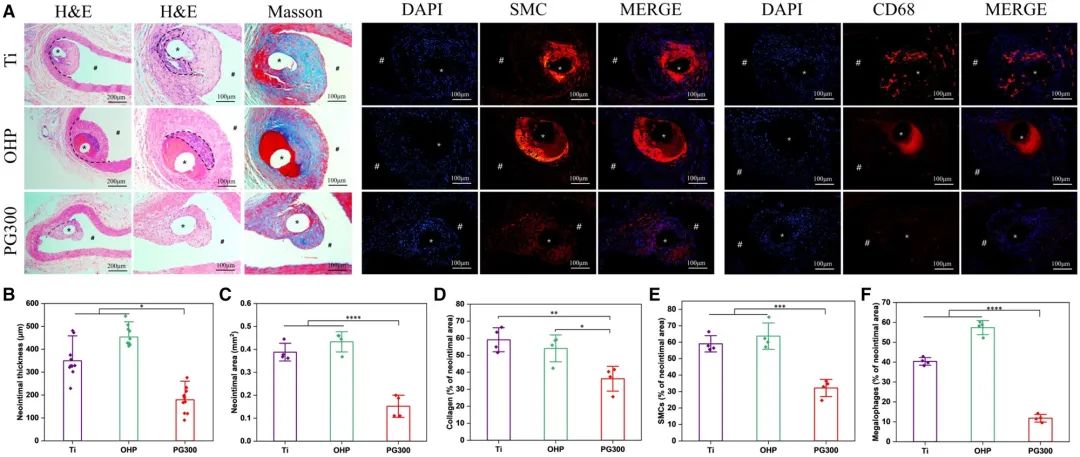
图12 体内实验安全评估。(A)样本植入大鼠腹主动脉30天后的H&E染色、Masson染色,以及α-SMA标记的SMCs和CD68标记的巨噬细胞免疫荧光图像(*:植入位点,#:血管腔道);(B)植入部位新生内膜厚度;(C)新生内膜面积定量统计;(D)胶原蛋白、(E)SMCs及(F)巨噬细胞在新生内膜中的百分比分布(均值±标准差,N=3;*P < 0.05,**P < 0.01,***P < 0.001,****P < 0.0001)。
使用动脉粥样硬化大鼠模型以评估GW3965修饰材料对AS的治疗效果。简言之,以高胆固醇饮食喂养SD大鼠1周,然后用液氮对腹主动脉进行冷冻处理。随后,在第2、3和4周分别进行VD₃腹腔注射,加速模型进程。7周后,构建出具有血栓特征的动脉粥样硬化病变,并进行了额外4周的样本植入,如图13A所示。液氮进入内皮并立即气化,导致冷诱导的内皮损伤。当内皮被快速冷冻和解冻时,膜结构被广泛破坏,内皮细胞因细胞内外冰晶形成而凋亡或死亡。随着屏障功能的破坏,动脉粥样硬化发生。VD₃作为一种钙诱导剂,促进血液中钙的吸收。高脂饮食增加了大鼠血液中脂质含量,使得脂质容易在血管壁积聚,然后与钙沉积结合,促进血管钙化,从而加速动脉病变和斑块的形成。图13B的H&E染色显示,与正常大鼠腹主动脉相比,造模5周后出现了明显的斑块形成,伴有不完整的内皮。斑块内的坏死核心(由黄色虚线突出显示)含有大量钙化物(蓝色箭头)和泡沫细胞(黄色箭头)。血管钙化可导致血管弹性降低,增加血管破裂和出血的风险。7周时,明显可见斑块破裂引起的血栓最终导致血管阻塞。两个随机模型的切片显示,动物模型在组织学上以坏死核心和血栓为特征。此外,7周时大鼠腹主动脉中大量脂质积聚,并被油红染色(图13C)。检测了模型组血液成分的变化。根据血脂四项结果,模型组的TG与正常组相比无显著差异,而TC和LDL-C分别增加了67%和52%。同时,HDL-C水平显著下降,表明模型动物处于典型的高胆固醇状态。总之,成功建立了具有坏死核心和血栓的AS大鼠模型,可用于研究样本在体内的治疗效果。
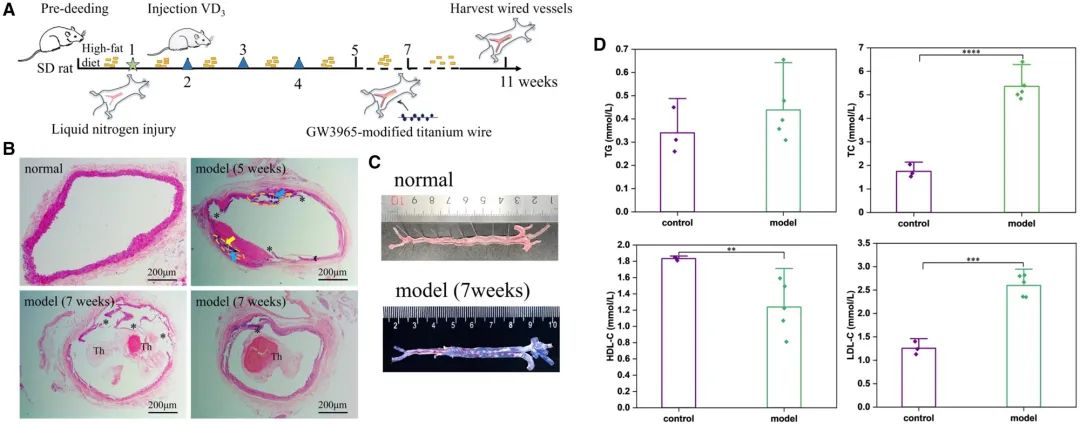
图13 动脉粥样硬化大鼠模型的建立。(A)动脉粥样硬化大鼠建模及后续样本植入过程概述;(B)正常组、损伤后组及高脂喂养5周与7周大鼠腹主动脉H&E染色对比;(C)模型构建7周后随机抽取两只大鼠主动脉大体油红染色;(D)血脂水平检测(均值±标准差,N=3;*P < 0.05,**P < 0.01,***P < 0.001,****P < 0.0001)。
由于LXR激动剂治疗可能导致肝毒性,我们首先探讨了GW3965修饰材料对肝脏的影响。将样本植入AS模型大鼠腹主动脉4周后,取出大鼠肝脏进行数码拍照并称重,以计算肝脏重量与体重的比值,并进一步测定肝脏甘油三酯水平(图14A、D和E)。肝脏大小、颜色、重量和甘油三酯均无显著差异,表明修饰材料未在肝脏中引起脂质堆积。H&E染色和油红O染色结果进一步证实,修饰材料无肝毒性(图14B和C)。此外,采集大鼠血液检测血脂四项和炎症因子四项,结果显示各指标相似,而炎症因子显著降低(图14F和G)。总体而言,修饰材料减轻了炎症,且未导致肝脏和血液甘油三酯水平升高。为验证材料的体内治疗效果,我们解剖了腹主动脉的植入部位并进行了染色分析。图15A显示钛丝组血管腔出现了新的动脉粥样硬化和血栓形成,导致血管狭窄。此外,钛丝组和OHP组的内皮仍处于不完整状态,且内皮下存在坏死核心。相比之下,PG300组的内膜组织相对完整。钛丝组、OHP组和PG300组的血管腔丢失率分别为51%、13%和14%(图15B),表明PAMAM和GW3965改善了AS模型中的血栓形成和腔丢失率。钛丝组和OHP组的新动脉粥样硬化斑块中大量积聚了泡沫细胞(虚线圈出区域),并被油红O染成红色。与钛丝组和OHP组相比,PG300组的脂质含量分别降低了90%和78%(图15C),表明经GW3965修饰的材料显著减少了斑块中的脂质积聚,有效提高了血管通畅率,这与之前的报道一致。

图14 GW3965修饰材料在肝脏及血清脂质中的代谢检测。(A)肝脏大体照片;(B)肝脏组织H&E染色及(C)油红O脂质染色;(D)全肝脂质提取物中TG定量分析;(E)肝重/体重、(F)血清脂质水平及(G)TNF-α含量检测(均值±标准差,N=3;*P < 0.05)。
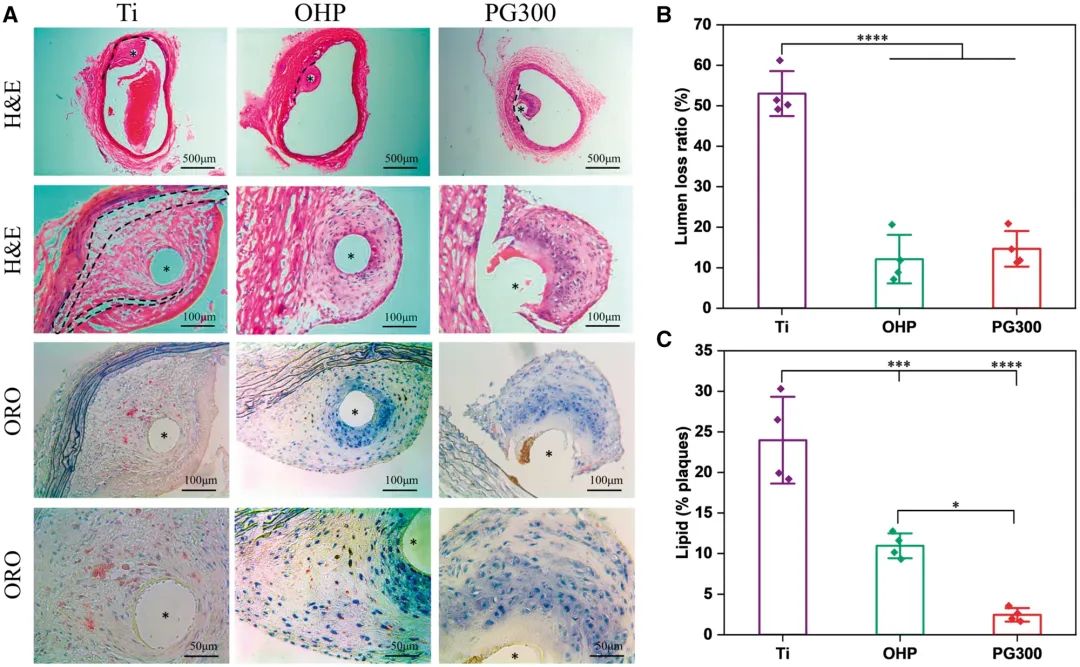
图15 GW3965修饰材料的体内实验。(A)H&E与油红O染色;(B)血管腔损失率定量分析;(C)斑块内脂质定量分析(均值±标准差,N=3;*P < 0.05,***P < 0.001,****P < 0.0001)。
三、讨论
PCI是心血管疾病的主要临床治疗方法,然而其生物相容性目前尚不充分,且晚期支架血栓形成和再狭窄等并发症一直存在。在病理条件下,动脉粥样硬化斑块的环境复杂,涉及多种细胞和信号通路,其中巨噬细胞在动脉粥样硬化的发生和发展中起着显著作用。在动脉粥样硬化的早期阶段,巨噬细胞数量的增加有助于消除脂质和炎症。然而,随着巨噬细胞吞噬过量脂蛋白,斑块中的巨噬细胞功能减弱,表现为迁移能力、吞噬效率和抗炎作用的下降,进一步促进复杂破裂斑块的发展。这些不稳定的斑块最终可能导致斑块破裂和局部动脉血栓形成。巨噬细胞是具有强塑性的多能细胞,参与脂质代谢、免疫和胞葬作用;然而,目前对动脉粥样硬化巨噬细胞的研究大多集中在靶向治疗上。因此,在本研究中,我们在材料表面引入了一种复合涂层,通过多通道调节巨噬细胞功能,将药物原位递送至动脉粥样硬化斑块,为介入治疗的可行性提供了基础。
LXR激动剂在动脉粥样硬化的治疗中显示出巨大潜力,但当以治疗剂量全身给药时,会导致肝脏脂质堆积和血清甘油三酯水平升高。在本研究中,我们将LXR激动剂(GW3965)引入材料表面,并将其原位递送至斑块内的靶细胞,以提高药物利用率,同时避免全身给药的副作用。各组之间肝脏和血清中的甘油三酯以及其他血清生化标志物(如胆固醇)均无差异(图14),肝脏重量与体重的比值也无差异。值得注意的是,经LXR激动剂治疗后,血清中TNF-α的水平显著降低。综合这些结果表明,GW3965修饰的材料可用于治疗动脉粥样硬化,且不会对血清和肝脏脂质水平产生干扰。动脉粥样硬化是一种可逆的动态过程,巨噬细胞的数量和表型影响斑块的进展和消退。研究表明,降低胆固醇可以有效减少巨噬细胞数量并缓解炎症,而有效的胞葬作用也会影响代谢和炎症。因此,通过促进巨噬细胞的胞葬作用、迁移或极化为促消退的M2表型来减少斑块中巨噬细胞含量,结合降低胆固醇含量和恢复胞葬作用,是动脉粥样硬化消退的有效手段。结合体内和体外实验,揭示了GW3965修饰材料对巨噬细胞诱导动脉粥样硬化斑块消退的能力,其机制可能如下。(i)调节病变部位巨噬细胞的脂质代谢以减少泡沫细胞形成,这是通过诱导ABCA1和ABCG1的表达增加胆固醇外流,以及下调LDLR的表达抑制脂质摄取来实现的;(ii)增加MerTK的表达,减少凋亡细胞的数量,从而进一步减少坏死核心;(iii)上调功能回归所需的因子CCR7的表达,减少巨噬细胞的数量;(iv)抑制炎症因子的释放,缓解斑块中的持续炎症(图16)。总体而言,本研究建立了一种超越靶向巨噬细胞的动脉粥样硬化治疗原位方法。在与病理微环境接触时,从材料中释放的分子进入细胞并影响基因表达。同时,通过调节动脉粥样硬化相关分子(如氧化低密度脂蛋白和炎症因子),从而介导细胞行为的变化以实现治疗效果。
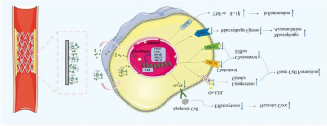
图16 LXR激动剂修饰材料处理后巨噬细胞与动脉粥样硬化相关联的信号通路的改变。
动脉粥样硬化斑块中泡沫细胞的数量取决于细胞募集、原位增殖、迁移和死亡。我们使用oxLDL刺激巨噬细胞,以在体外模拟斑块中的泡沫细胞,发现GW3965修饰的材料减少了正常巨噬细胞以及泡沫细胞的粘附。结合CCR7表达的上调,这表明GW3965修饰材料可能从两个方面影响泡沫细胞的数量。一方面通过调节细胞内胆固醇水平发挥作用,另一方面,逆转了胆固醇负荷细胞的迁移。此外,炎症巨噬细胞和泡沫细胞的减少也在一定程度上减少了斑块内的持续炎症(图5)。然而,与之前的研究不一致的是,GW3965修饰的材料并未显示出诱导巨噬细胞重编程的作用,即巨噬细胞从M1表型转变为M2表型。根据FCM的结果,M1显著减少,而M2仅略有增加且无显著差异,表明GW3965修饰的材料可能主要通过减少M1巨噬细胞的数量来抑制炎症。这种现象可能是由于与纳米系统相比,材料表面的接枝和释放量存在差异,以及RAW264.7细胞系极化能力有限。此外,我们还探讨了材料对细胞内分子水平的影响,GW3965修饰材料对巨噬细胞的调节作用,除了停留在细胞水平外,还从分子水平改变了巨噬细胞的炎症、氧化和脂质状态。
对于植入式医疗器械中的生物材料,优异的血液相容性是植入安全性的前提,而植入后的血栓形成也是一个亟待解决的紧迫问题。钛基材料因其优越的生物相容性常被用作植入材料,但钛诱导的高血栓活性限制了其在临床上的应用。在本研究中,我们还在钛的基础上验证了修饰材料的血液相容性。对钛进行碱激活处理后,粗糙度的增加和复杂的微观结构增强了血小板的粘附、激活和聚集以及释放。引入PAMAM可能平滑了基底表面形态,并使微观结构趋于简单,从而减少了血小板的粘附和激活,并促进了抗凝血特性。同时,PAMAM提高了材料的亲水性,吸附在亲水表面的白蛋白在一定时间内对血小板的吸附具有阻断作用。总体而言,OHP材料在短时间内展现出良好的抗凝血效果。LXR激动剂在脂质和炎症方面已得到广泛研究,但在抗凝血方面的报道却很少。基于LXR配体通过抑制钙释放来调节血小板功能的能力,Spyridon等人提出了另一种机制,可能有助于LXR配体的抗动脉粥样硬化效果,即它们的非基因组抗血栓形成效果。GW3965修饰材料在30分钟内表现出高吸光度和BCI,而PG500的抗凝血效果随着时间的延长(45-60 min)而降低。这可能是由于材料与全血接触时间较长后,材料表面或血液中的除血小板以外的血细胞对凝血产生影响,从而降低了PG500材料表面的BCI。
四、结论
在本研究中,我们提出了一种治疗性表面工程策略,即从材料生物学的角度出发,将GW3965引入器械表面,以调节病理微环境,原位干预动脉粥样硬化的消退。总之,我们的研究表明,GW3965修饰的材料表现出抗动脉粥样硬化的能力,这可能主要是由于其通过多通道对巨噬细胞功能进行基因调控,这些通道包括脂质代谢、炎症反应、胞葬作用和细胞迁移,同时结合其非基因抗血栓作用。因此,作为治疗动脉粥样硬化的植入材料,它不仅减轻了已存在病变的斑块负担,还降低了血栓形成的风险。总体而言,GW3965修饰的材料在治疗动脉粥样硬化方面具有很大的潜力,并且可以作为血管支架做进一步的探索。